Много лет химики-органики безуспешно пытались получить соединение, в котором атом железа был бы непосредственно соединен с атомом углерода. Удача пришла неожиданно и совсем недавно с открытием ферроцена. Тем самым была открыта новая яркая глава в химии металлоорганических соединений. Огромный вклад в эту область внесла советская школа металлооргаников, возглавляемая академиком А. Н. Несмеяновым.
О ферроцене, истории его открытия, о его применении, и рассказывается в этой статье.
С ЧЕГО ВСЕ НАЧАЛОСЬ!
Все началось с того, что некий студент-химик обратился к своему научному руководителю за темой очередной работы, а тот, вовсе не думая ни о, каких открытиях, велел юноше провести одну давно известную химическую реакцию, но в несколько измененном варианте.
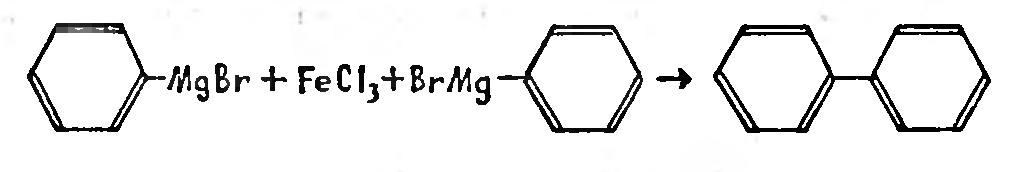
С давних пор химикам было известно, что если взять магнийорганическое соединение бензола, в котором к атому магния с одной стороны присоединен атом, брома, а с другой - шестичленное бензольное кольцо, и подействовать на это соединение хлорным железом, то происходит сдваивание двух колец, и получается дифенил.
И вот в 1951 году молодой шотландский химик Р. Посон поручил еще более молодому дипломнику Т. Кили провести аналогичную реакцию, но вместо 1 бензола взять циклопентадиен, то есть соединение, похожее на бензол, только "содержащее на один углеродный атом меньше. Посон решил скопировать давно известную реакцию, но при этом получить новую молекулу, состоящую из двух циклопентадиеновых колец.
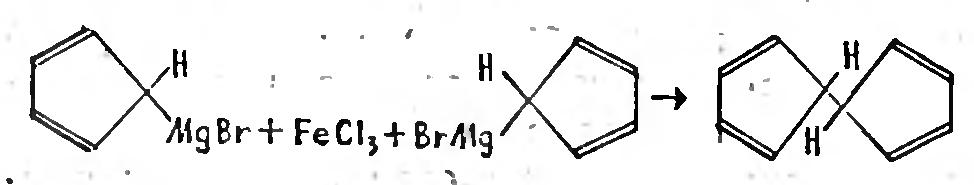
В известной реакции получения дифенила железо играло роль катализатора и Посон, когда собирался провести «свою» реакцию, думать не думал о том, что оно может выступить в, каком-то ином амплуа.
Итак, реакцию провели..., и выделили вместо желаемого продукта, какое-то оранжево-желтое вещество, кристаллическое, устойчивое. К огромному изумлению первооткрывателей, оно состояло из углерода, водорода и. железа!
Тут действительно было чему удивляться. Ведь уже добрую сотню лет химики пытались получить металлоорганическое соединение железа (то есть такое соединение, в котором железо было бы непосредственно связано с углеродом), но все напрасно. Появлялись статьи, в которых авторы сообщали о получении таких соединений, но другие исследователи повторяли описанные опыты и благополучно «закрывали» лжеоткрытия. Так, что к середине нашего столетия химики сделали вывод о невозможности существования железоорганических соединений. В крайнем случае, думали они, если такие вещества, и будут получены, то они окажутся весьма неустойчивыми.
И вдруг получено соединение, устойчивое до 400 СС (чему могут позавидовать многие органические вещества), соединение, не разрушающееся кислотами, и щелочами. Соединение, в молекулу которого наряду с атомом железа входит по десять атомов углерода, и водорода.
Как же оно построено? Уже через год Р. Вудворд (знаменитый Вудворд, получивший 15 лет спустя Нобелевскую премию за синтез хлорофилла) и Дж. Уилкинсон облучили кристаллы необычного вещества рентгеновскими лучами, и показали, что его молекула представляет собой этакий «бутерброд», в котором атом железа зажат с двух сторон плоскими параллельными «ломтями» циклопентадиенильных колец.
Тот же Вудворд предложил для нового вещества название «ферроцен». А картинка «бутерброда» из циклопентадиенильных ломтей с железной начинкой стала общепринятым в научной литературе изображением ферроцена.
Неправда ли, есть, что-то забавное в этой конструкции? Читателю, наверное, помнятся загадочные картинки - друдлы, популярные в начале шестидесятых годов. Один из друдлов - бутерброд с помидором - очень похож на схематическое изображение ферроцена.
СЛУЧАЙНОЕ ОТКРЫТИЕ
Случайным ли было открытие ферроцена?
В науке бывают такие ситуации, когда назревает необходимость открытия - будь то обобщение накопленных результатов (например, периодический закон) или открытие нового соединения. В таких случаях открывателю нужно спешить чуть замешкаешься, и вместо тебя откроют другие. Это, конечно, шутка - ведь открытия, о которых мы говорим, делаются «случайно». Но не удивительно ли в том же 1951 году появляется второе сообщение о синтезе ферроцена, проведенном независимо от Посона, и совсем другим путем. Английский исследователь С. Миллер с сотрудниками получил ферроцен прямо из циклопентадиена и металлического железа. Причем ученый не ставил своей целью синтезировать железоорганическое вещество, а просто пытался использовать железо, как катализатор.
Ясно, что совпадение дат - случайность. Но ясно также, что если бы ферроцен не был открыт в 1951 году, он наверняка был бы получен через год или два. Был бы открыт тоже случайно, ибо теоретически его тогда предсказать было невозможно.
Структура соединения, в котором один атом железа одновременно связан с десятью (!) атомами углерода, настолько необычна, что она никак не могла прийти ни в голову химику, ни в электронный мозг вычислительной машины. Уже после открытия ферроцена его существование было «оправдано» советскими учеными Е. М. Шусторовичем и М. Е. Дяткиной. Они провели сложный квантовомеханический расчет орбит всех электронов, которые накрепко привязывают железо к двум углеводородным кольцам.
(Не следует думать, однако, что железо в ферроцене десятивалентно; о том, как осуществляется связь в ферроцене, рассказывает подпись к рисунку справа.)
Надо сказать, что при всей неожиданности и необычности таких находок, как ферроцен, пути к ним, как правило, прямы, и закономерны.
Весь ход развития науки к середине нашего столетия заставил химиков повысить интерес к циклопентадиену ведь он содержится в нефти. Сходный с ним по строению бензол был уже исследован вдоль и поперек - недаром шестизвенное бензольное кольцо стало символом органической химии, а циклопентадиен, содержащий на один углеродный атом меньше, привлекал химиков своей неизученностью. Он сулил ученым открытие новых реакций, среди которых могли быть, и такие, которые отличали его от бензола. Вероятность получения металлоорганического производного циклопентадиена была велика.
Любопытная подробность впоследствии оказалось, что незадолго перед второй мировой войной инженеры одной из английских фирм, желая очистить циклопентадиен, пропускали его через нагретые железные трубы. Однако цели своей они не достигли - трубы быстро забивались, каким-то рыжим порошком, и установка быстро выходила из строя. К сожалению, огорченные исследователи не заинтересовались этим злополучным «засорителем»
УДИВИТЕЛЬНЫЕ СВОЙСТВА
На нет, и суда нет. Не стоит укорять незадачливых инженеров за то, что они не проявили должного любопытства в истории с засорявшимися трубами, и упустили случай сделать открытие. Зато уж после того, как ферроцен был открыт «по-настоящему», вниманием ученых он обделен не был. Десятки исследователей в разных странах мира занялись изучением нового, столь необычного соединения. Интерес к нему не ослабевает, и сейчас, через двадцать с лишним лет после его открытия, а ведь за эти двадцать лет опубликованы сотни статей, посвященных исследованию физических, и химических свойств ферроцена. Огромный вклад в эту область внесла школа металлооргаников, возглавляемая академиком Александром Николаевичем Несмеяновым. Множество работ по химии ферроцена выполнили под руководством А. Н. Несмеянова сотрудники МГУ, и Института элементоорганических соединений Академии наук СССР Э. Г. Перевалова, В. А. Сазонова, С. П. Губин, Л. П. Юрьева, и другие.
Каковы же химические свойства ферроцена? Уже вскоре после его открытия было установлено, что ферроцен очень похож по своему поведению на бензол, то есть представляет собой ароматическую систему. Больше того, многие реакции, свойственные ароматическим углеводородам, протекают с ферроценом легче, чем с самим бензолом. Уже давно было известно, что в бензоле один из атомов водорода может замещаться на ацетильную группу (СОСН3); при этом получается вещество с приятным черемуховым запахом - ацетофенон. Эта одна из наиболее характерных для бензола реакций, и была первой реакцией, примененной к ферроцену. Ацетильная группа замещает атом водорода в одном из ломтей молекулы-бутерброда - одном из цик-лопентадиенильных колец, и получается аце-тилферроцен - красное кристаллическое вещество с сильным, довольно приятным запахом.
Но ведь у ферроцена есть, и второе кольцо. И оно тоже может принимать заместитель. Однако второй заместитель вступает во второе кольцо менее охотно, чем первый. Значит, в ацетилферроцене первый заместитель воздействует на второе кольцо через атом железа.
Таким образом, циклопентадиенильные ломти ферроценового сандвича ведут себя подобно бензолу, а железная прослойка не просто скрепляет две крышки, но, и передает влияние одной крышки на Другую.
Далее. Ферроцен - это не просто ароматический углеводород, как бензол, ведь в его молекуле - атом железа, металла. Отражается ли это на свойствах ферроцена? Да, и в первую очередь это проявляется в его способности окисляться в фиолетовый катион феррициния. Напомним, что железо может быть двухи трехвалентным. В ферроцене оно двухвалентно, а окислитель, например, азотная кислота, отнимает от ферроцена электрон, и переводит его в фер-рициний - катион, в котором железо уже трехвалентно.
Поистине, удивительны свойства этого вещества, представляющего собой одновременно, и углеводород, и металл, и в то же время ни то, и ни другое! Ферроцен оказался на стыке двух наук химии неорганической, и химии органической.
НЕ ТОЛЬКО ФЕРРОЦЕН
В то время, как одни исследователи сосредоточили свое внимание на изучении органической химии ферроцена, другие стали искать аналогичные соединения других металлов. В результате исследований многих ученых стало известно огромное количество циклопентадиенильных производных почти всех металлов менделеевской таблицы. Здесь в первую очередь металлоцены - соединения, полностью аналогичные ферроцену. Однако такие производные устойчивы только для двух аналогов железа по периодической системе - для рутения, и осмия (как видим, система Менделеева, и в этом случае может сослужить хорошую службу для предсказания свойств еще не полученных металлоорганических соединений).
Некоторые из таких веществ получаются из самого ферроцена. Так, А. Н. Несмеянов и Н. А. Волькенау нашли, что один из циклопентадиенильных ломтей в ферроценовом «бутерброде» легко заменить на бензол.
Этот факт стоит того, чтобы обратить на него особое внимание. Целое столетие химики пытались найти хоть, какое-нибудь органическое вещество, соединяясь с которым железо вступило бы в непосредственную устойчивую связь с углеродом. И вот обнаруживается, что такое соединение железо может образовать с бензолом, прекрасно известным с давних времен. И узнали об этом только в 1963 году!
В своеобразном бутерброде с помидором, с которым мы сравнили ферроцен, можно менять начинку - ставить вместо железа, например, рутений или осмий. Оказалось, что можно менять, и ломти. Обнаружилось, что железо, и многие другие металлы могут входить на правах помидора в бутерброды, где ломтями служат две молекулы бензола, а не циклопентадиен, как в металлоценах.
Это для «нормальных» по размерам металлов. Ну, а, как быть с такими тяжелыми элементами, как уран? Продолжая гастрономическое сравнение, можно сказать, что его атом - это уже не помидор, а целый арбуз или тыква. И тут циклопентадиенильный или бензольный ломти оказываются беспомощно малыми, чтобы, как следует прикрыть центральное ядро. Но в богатейшей кухне природы нашлись такие огромные «хлебы», которые позволили приготовить бутерброд, и с урановой (и с плутониевой, и с нептуниевой) начинкой. Мы имеем в виду полученный совсем недавно (и на этот раз отнюдь не случайно) бис(циклооктатетраенил)уран. В качестве ломтей в этом бутерброде выступает циклический углеводород, скелет которого состоит из восьми атомов углерода. По аналогии с ферроценом такое вещество названо ураноценом (см. рисунок).
ЧТО ДЕЛАЮТ ИЗ ФЕРРОЦЕНА!
В наши дни резко сократилось время, которое проходит от открытия, какого-либо явления -или вещества до его применения в практике. Не успеет химик получить на дне колбы, какие-то кристаллы *или жидкость, как он уже думает, а где их можно использовать?
Открытие ферроцена стимулировало развитие целой области металлоорганической химии, приведшее к синтезу огромного количества новых веществ. Однако сам ферроцен остается наиболее устойчивым, наиболее доступным, наиболее дешевым продуктом. И притом нашедшим наиболее широкое применение. Да, несмотря на свою «молодость», ферроцен уже работает на пользу людям. Применяется он в самых различных сферах.
Добавка 0,01% ферроцена к дизельному топливу улучшает горение в дизельных двигателях. Ферроцен обладает антидетонационными свойствами, стабилизирует топливо. Соединения ферроцена, содержащие некоторые другие металлы, используются для стабилизации полимеров. Вещества на основе ферроцена применяются, как красители различных цветов для тканей, из них изготавливают чернила, инсектициды. Ферроцен оказался подходящим реагентом для аналитической химии. Непредельные производные ферроцена используются для получения полимеров, и сополимеров, а из кремнийорганических производных ферроцена получают термостойкие полимерные материалы. Ферроцен нашел применение в гистохимии красителями, созданными на его основе, окрашивают срезы живых тканей перед наблюдением под микроскопом.
Разумеется, из металлоорганических соединений не только ферроцен может служить людям.
Несколько лет назад М. Е. Вольпин и В. Б. Шур в Институте элементоорганических соединений открыли новую реакцию, позволяющую при помощи циклопентадиенильных производных некоторых металлов (например, титана) переводить свободный молекулярный азот в соединения азота, такие, как аммиак или амины. Помимо большого теоретического значения, эта реакция имеет поистине громадные перспективы практического применения. Ведь азот, запасы которого в атмосфере неограниченны, этот свободный азот так мало активен, так неохотно образует химические соединения! А соединения азота - это, и волокна, и пластмассы, и лекарства, и ракетное топливо, и в первую очередь удобрения. И все это можно будет получить в буквальном смысле из воздуха при помощи металлоорганических соединений!
Давно уже химиков, и биологов волнует тайна великого процесса, происходящего в природе, - синтеза органических веществ из углекислого газа, и воды, который осуществляется в зеленом листе при помощи хлорофилла. Пока растения по миллионолетней привычке перерабатывают углекислый газ из воздуха в клетчатку, ученые ищут пути получения органических веществ из углекислого газа не в нежных зеленых листочках, а в огромных химических реакторах. М. Е. Вольпин и И. С. Коломников обнаружили, что металлоорганические комплексы, помогающие связывать азот, могут быть успешно применены для того, чтобы улавливать из воздуха углекислый газ, и превращать его в ценные органические соединения.
Необходимо упомянуть, и ° том, что металлоорганические соединения находят важное применение в каталитических процессах. В этих реакциях из органической молекулы, и металла образуются неустойчивые металлоорганические производные, которые тут же распадаются, но в результате распада получаются не исходные компоненты, а уже другие органические вещества.
Так, например, со школьной скамьи известно, что из ацетилена можно получить бензол. Легко расширить спектр веществ, получающихся при полимеризации ацетилена, заставляя его образовывать неустойчивые никель-органические производные. Среди продуктов их распада отметим стирол, очень ценное сырье для полимерной промышленности.
ФЕРРОЦЕН И ДЫХАНИЕ, МЕТАЛЛООРГАНИЧЕСКИЕ ВЕЩЕСТВА И ЗДОРОВЬЕ
Как мы дышим? Давайте рассмотрим этот вопрос не с физиологической, не с медицинской, не с физической точек зрения, а с точки зрения химической. Посмотрите на рисунок, помещенный на следующей странице вверху. На нем изображена молекула гемоглобина. Ее основной, центральной частью является атом железа, связанный одновременно с четырьмя атомами азота, и двумя молекулами сложного белка - глобина. Связь атома железа с одной из белковых молекул не очень прочная, и, если подействовать на гемоглобин кислородом, то молекула О2 встанет на место глобина - образуется оксигемоглобин. Этот процесс, и происходит в легких. Молекула оксигемоглобина отправляется в красном кровяном шарике в путешествие по всему организму, пока не дойдет до, какой-нибудь клетки. Здесь кислород отщепляется - он нужен для сожжения углеводов. При этом образуется углекислый газ, и выделяется тепло, необходимое организму. А отдавшему свой кислород гемоглобину предстоит вернуться в легкие для подзарядки кислородом.
К сожалению, кислород - не единственное вещество, способное присоединиться к железу гемоглобина. Окись углерода, например, тоже садится на атом железа, да так, что ее потом от него уже никакими силами не оторвешь. У человека, отравленного угарным газом, гемоглобин не способен переносить кислород, ведь его место уже навсегда занято окисью углерода. А это тут же приводит к смерти.
- Читатель, наверное, уже начинает недоумевать статья посвящена ферроцену, и родственным ему металлоорганическим соединениям - при чем же тут гемоглобин? А дело вот в чем.
Железо входит в состав гемоглобина крови. Ферроцен содержит железо. Эти два соображения явились отправным пунктом исследования А. Н. Несмеянова, Н. С. Кочетковой и В. Д. Вильчевской, приведшего к созданию медицинского препарата ферроцерона. Ферроцерон, представляющий собой производное ферроцена, явился исключительно эффективным лекарством, позволяющим за очень короткий срок резко повысить содержание гемоглобина в крови.
Ферроцерон гораздо успешнее других препаратов излечивает некоторые виды анемии. Больше того, Оказалось, что это соединение прекрасно справляется со многими другими болезнями, которые связаны с недостатком железа в организме (например, с такой неприятной болезнью, как зловонный насморк - озена).
Ферроцероном отнюдь не ограничивается применение ферроцена в медицине. Из других его производных получают препараты, обладающие бактерицидным действием, их применяют, как дезинфекторы. Ферроцены, содержащие некоторые азотистые основания, являются основой лекарств против ожирения.
Любопытно заметить хотя ферроцен, и оказывает такое эффективное биологическое воздействие, однако в природе он не встречается, и вряд ли, когда-нибудь его производные будут обнаружены в природных веществах.
А встречаются ли, какие-либо другие металлоорганические соединения в продуктах, выделенных из животных, и растительных-* организмов?
Ответим в первую очередь на весьма вероятное восклицание читателя «А гемоглобин?!» Строго говоря, это соединение - по крайней мере его часть, подробно изображенную на рисунке, так называемый гем, - нельзя отнести к таким веществам. В начале статьи мы неспроста оговорились, что к металлоорганическим относятся только те соединения, в которых атом металла непосредственно связан с атомом углерода. А в геме железо непосредственно соединяется с четырьмя атомами азота.
Но есть одно очень сложное, и очень важное природное соединение, в котором (точнее, в одной из его форм) атом металла связан с углеродом. Взгляните на рисунок внизу, на котором изображена коферментная форма витамина В12/ Сначала вы, видимо, растеряетесь перед сложностью структуры, но потом, внимательно приглядевшись, обнаружите, что центральный атом кобальта в витамине В12 связан с пятью атомами азота (похоже на гем!), и с одним атомом углерода. Именно эта связь и делает все соединение металлоорганическим.
Витамин В12 - очень красивое рубиново-квасное кристаллическое вещество - выделен впервые из печени теплокровных животных в 1948 году. Оказалось, что это соединение успешно излечивает считавшуюся ранее смертельной пернициозную анемию. Витамин В]2 вместе со специфическим белком участвует в производстве красных кровяных шариков в организме.
Как видим, велико значение металлоорганических соединений не только в современной химии, но, и в самой природе. А одно из самых почетных мест среди таких соединений принадлежит ферроцену.
Бесспорно, что уже в ближайшее время ферроцен найдет новые важные применения в самых различных областях. Исследование свойств чудесного соединения продолжается.
ЛИТЕРАТУРА
А. П. Несмеянов. Химия ферроцена. М 1969.
М. Грин. Металлоорганические соединения переходных элементов. М., 1972.
П. Посон. Химия металлоорганических соединений. М., 1970.




