Вирусы для развития
Древние вирусы управляют судьбой эмбриональных стволовых клеток и помогают создать изолирующую оболочку на нервах.
Львиную долю нашего – и не только нашего – генома составляют так называемые мусорные последовательности, которые не кодируют никаких белков и никаких регуляторных РНК. Несколько процентов от мусорной ДНК приходится на так называемые эндогенные ретровирусы, о которых мы когда-то подробно рассказывали. У них интересная судьба – когда-то они были просто ретровирусами, способными встраивать свой геном в геном клетки, как это делает современный ретровирус ВИЧ. Встроившись, вирус может на какое-то время заснуть, передаваясь дочерним клеткам вместе с клеточной ДНК. И может случиться так, что вирус не проснётся – сама клетка старается держать вирусные последовательности под контролем, а кроме того, в вирусную последовательность может попасть мутация, которая отключит способность вируса размножаться, производить собственные белки и т. д. («Внутренний» вирус может существовать в виде мобильного генетического элемента ретротранспозона; мобильными их называют потому, что они копируют самих себя в новые участки генома, но взаимосвязи между ретровирусами и реттротранспозонами – это отдельная тема.)
При этом организм способен извлечь пользу из заснувшего и повреждённого вируса, используя вирусные белки в своём хозяйстве. Таких примеров много, причём часто эндогенные ретровирусы используются во время эмбрионального развития. Один такой пример описан в недавней статье в Science Advances, в которой сотрудники Испанского национального онкоцентра пишут об эндоретровирусном белке MERVL-gag (на его ретровирусность указывают буквы ERV). Он помогает эмбриону в развитии, когда связывается с другим белком – «настоящим» клеточным белком URI.
Сам URI нужен для того, чтобы защитить от расщепления ещё два других белка, которые помогающих зародышевым стволовым клеткам перейти из тотипотентного состояния в плюрипотентное. Когда мы говорим о зародышевых клетках, то обычно имеем в виду их умение бесконечно делиться и их способность давать начало любому специализированному типу клеток – клеткам мышц, клеткам кожи, крови и т. д. Но на самом деле «всемогущество» зародышевых клеток постепенно меняется. По-настоящему «всемогущими», то есть тотипотентными, являются оплодотворённые яйцеклетки и те, которые образуются из яйцеклеток на самых-самых ранних этапах эмбрионального развития. Потом клетки эмбриона становятся плюрипотентными – они могут очень многое, но уже не всё (в детали того, что они могут, а чего не могут, мы сейчас вдаваться не будем). По мере развития организма «потентность» стволовых клеток ограничивается ещё и ещё, и в конце концов наши стволовые клетки, с которыми мы живём после рождения, становятся способны давать начало только определённой ткани, поэтому мы говорим о стволовых клетках крови, стволовых клетках печени и пр.
При этом без перехода от тотипотентности к плюрипотентности никакого развития не получится. Белок URI как раз помогает перейти от полного «всемогущества» к неполному – помогает тем, что обеспечивает активность других регуляторных белков, управляющих «потентностью». Если белка URI нет, то эмбриональное развитие останавливается. Но и без изначальной тотипотентности всё же никак – и сама яйцеклетка, и первые клетки, образующиеся при её дроблении, должны быть абсолютно «всемогущими», иначе у эмбриона не сформируется всё, что нужно. И вот настаёт черёд эндоретровирусного MERVL-gag. Сначала его в зародыше много, он блокирует URI и тем самым поддерживает тотипотентность. Потом уровень MERVL-gag падает, URI освобождается от его влияния и способствует переходу зародышевых клеток в чуть менее «потентное» состояние. То есть MERVL-gag служит дополнительным регулятором эмбрионального развития, помогая понизить «потентность» клеток в правильное время и в правильном темпе.
Другой свежий пример того, как приручённые ретровирусы начинают приносить пользу клетке, описывают в Cell сотрудники Кембриджского университета. Они искали последовательности ДНК, регулирующие формирование миелина. Так называют липидную оболочку на длинных нейронных отростках аксонах – она одновременно ускоряет электрохимические импульсы, бегущие по аксонам, и изолирует их друг от друга, не допуская «короткого замыкания» между нейронными «проводами». Миелин изучают давно, но в том, какие гены им занимаются, какие белки они кодируют и как эти белки взаимодействуют друг с другом, остаётся много белых пятен. (Достаточно сказать, что миелиновую оболочку на нейронных отростках делают не сами нейроны, а вспомогательные клетки олигодендроциты, которые окутывают аксоны слоями собственной мембраны.)
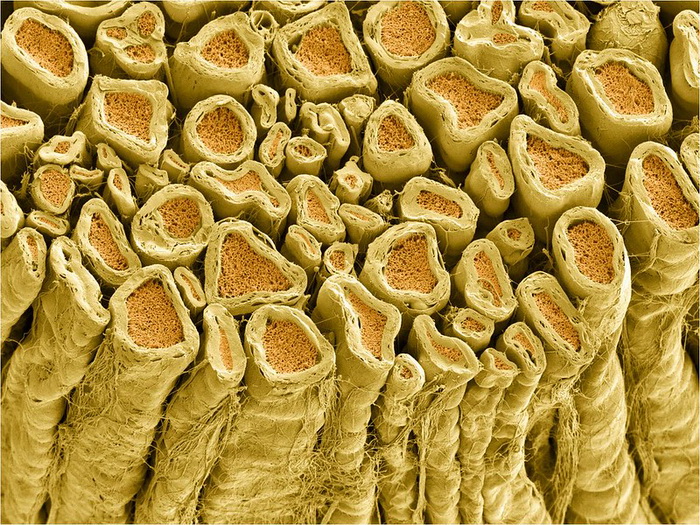
Поперечный срез через пучок миелинизированных отростков-аксонов в спинном мозге крысы. Фото: NIH Image Gallery / Flickr.com
Исследователи обнаружили в геноме некую область, которая, судя по некоторым особенностям, в прошлом была ретротранспозоном, который произошёл от древнего ретровируса. Область назвали «ретромиелином», и когда её инактивировали в клетках крысы, то из клеток следом исчез основной белок миелина – это официальное название белка, без которого миелиновая оболочка не сформируется. Молекулярно-механически тут происходило следующее: на «ретромиелиновой» ДНК-последовательности синтезировалась РНК, которая, в свою очередь, мешала работать регуляторному белку, запускающему ген основного белка миелина.
«Ретромиелиновые» последовательности нашли в геномах двадцати двух видов челюстноротых позвоночных – к ним относятся звери, птицы, рыбы, амфибии, рептилии. Миелин считается их эволюционным ноу-хау, он позволяет быстро передавать импульсы по тонким отросткам на большие расстояния, и если бы его не было, нервные «провода» приходилось бы делать очень толстыми (как это происходит у гигантских кальмаров, которые, как все беспозвоночные, живут без миелина). Делать нервы толстыми можно только до определённого предела, да и в целом утолщение нейронных отростков несёт много конструкционных неудобств. Поэтому можно сказать, что миелиновая оболочка, позволяющая сохранить нервы тонкими на большом расстоянии, была одним из тех изобретений, благодаря которым на земле возникли слоны, киты, жирафы, длинные анаконды и пр. Приручённый ретровирус помог усовершенствовать нервную систему, а это, в свою очередь, подарило позвоночным новые эволюционные возможности.



