3D кровеносные сосуды: как настоящие, но лучше
Один из участников недавнего III Конгресса молодых учёных, организованного Фондом «Росконгресс» в рамках Десятилетия Науки и технологий, – Александр Захаров, студент 6 курса лечебного факультета Рязанского медицинского университета, привёз необычную разработку – искусственные кровеносные сосуды, полученные с помощью 3D-печати. О том, как это работает и что может изменить в практической медицине, мы спросили самого Александра.
— Александр, что представляет собой ваша разработка?
— Я представлял на Конгрессе молодых учёных запатентованные нами литейные формы, которые изготавливаются методом 3D-печати и позволяют получать сосудистые протезы из гидрогелей, заселённых клетками. Они могут служить как практическими пособиями для отработки хирургических навыков, так в перспективе и как трансплантаты. Нами выигран грант по программе «Студенческий стартап» в размере одного миллиона рублей для разработки улучшенной универсальной литейной формы, что позволит получать сосуды уже не фиксированного типа, а различного диаметра, морфологии, разных видов ответвлений в зависимости от потребностей конкретного пациента.
— С чего начинался ваш проект?
— Начался это проект на четвёртом курсе университета, когда мы работали в лаборатории клеточных технологий. Мне пришла в голову идея, почему бы нам в этой лаборатории не заняться чем-то, позволяющим выращивать искусственные органы. Я работал в это время в эндотелиальной группе, которая занимается клетками сосудистой стенки, и логичным решением стало попробовать вырастить кровеносные сосуды человека. Я предложил эту идею научному руководителю, и мы начали работать.
— Как это выглядело? Вот вы решили работать, научный руководитель говорит: «Ну, давай!» – а что дальше?
— Мы оформили заявку на научно-исследовательскую работу от университета и начали работать с литейными формами. Вопрос стоял о технологии выращивания сосудистых протезов – для получения искусственных органов существуют технологии биопринтинга. Они дорогостоящие, требуют высокой квалификации персонала для их эксплуатации.
Мы решили исходить из тех средств, которые имелись в нашем университете, и связались с нашим центром аддитивных технологий. Они предоставили нам 3D-принтер, находящийся на базе университетского вивария. Мы решили использовать такую печать для формовки гидрогелей в трубчатые структуры сосудистых протезов и начали разрабатывать литейные формы.
— Что представляет собой литейная форма?
— Это запатентованная нами модульная конструкция, состоящая из 13 деталей различного типа. Детали изготавливаются из фотополимерной полиметилметакрилат-подобной смолы, затвердевающей за счёт послойного ультрафиолетового облучения. В конструкции литейной формы предусмотрены пять типов деталей. Это «стержень», который формирует ось будущей модели сосуда, а заодно и его просвет; два «полуцилиндра», необходимых для формирования стенок сосудистой модели, также они содержат отверстия для контакта гидрогеля с полимеризующим (сшивающим) раствором; две «подставки» – они нужны для закрепления и правильного ориентирования предыдущих деталей друг относительно друга и придания ей устойчивости; четыре «крышки» – они дополнительно скрепляют все выше перечисленные детали для придания литейной форме прочности; четыре «заглушки», нужные для закрытия и открытия отверстий в полуцилиндрах, для регулирования времени и интенсивности контакта гидрогеля со сшивающим раствором. Вся эта конструкция и позволяет нам формировать гидрогели.
А гидрогели, в свою очередь, представляют собой аморфные жидкостные соединения трубчатой формы. Такую форму они приобретают уже после полимеризации («сшивания») раствором в нашей литейной форме.
— А что представляет собой полимеризация?
— С химической точки зрения, за счёт действия полимеризующего раствора, мы вносим в молекулы биополимеров в составе нашего гидрогеля дополнительные химические связи, чем способствуем формированию пространственной ориентации ранее хаотично ориентированных цепей биополимеров. Такое воздействие вызывает изменение структуры гидрогеля: он становится более прочным, эластичным и способным сохранять приданную ему форму. Этот процесс как раз и называется полимеризацией, или сшивкой. На выходе после сборки формы мы получаем довольно прочную полимерную структуру, по форме напоминающую кровеносный сосуд.
— Зачем нужно создавать искусственные кровеносные сосуды?
— Сейчас во всём мире и в России в частности растёт количество сердечно-сосудистых заболеваний. Они лидируют в структуре заболеваемости и смертности. Кроме того, ведущее место в этой проблеме занимает атеросклероз, особенно облитерирующая его форма, нередко требующая замены целых участков сосудистого русла, пересадки сосудистых протезов вместо повреждённых сосудов. К сожалению, сейчас здесь возможно только использование аутотрансплантатов пациента, децеллюляризованных матриксов животных или искусственных протезов на основе ПТФЭ (политетрафторэтилена) или дакрона.
— Почему это плохо?
— Они обладают рядом недостатков – например, нередко ведут к иммунологическому отторжению, тромбообразованию, стенозам и инфекционному воспалению, и такие риски довольно высоки. В течение пяти лет и более, возможно, потребуется новое оперативное вмешательство по замене того трансплантата, который приживили пациенту.
— А в вашем случае таких рисков нет?
— Мы пытаемся найти выход путём разработки биоинженерных сосудистых протезов, совместимых с организмом пациента. По нашему замыслу, они будут иметь минимальный риск тромбируемости и отторжения, а также хорошие физические свойства для использования крови под давлением.
— Почему вы думаете, что ваши сосудистые протезы будут иметь все эти достоинства и не будут иметь недостатков предыдущих разработок?
— Мы не исключаем, что они тоже могут иметь недостатки, но мы планомерно работаем над совершенствованием нашего продукта. В частности, недавно мы провели исследование, в котором выяснили, что наши сосудистые протезы могут выдерживать артериальное давление 300 мм ртутного столба и более.
— А зачем это нужно? Ведь такого давления у людей не бывает.
— Большинство пациентов с сердечно-сосудистыми заболеваниями страдают гипертонической болезнью и во время гипертонических кризов их систолическое давление может доходить до 200 мм ртутного столба и более. Соответственно, чтобы наш сосудистый протез не разорвался от таких скачков кровяного давления, он должен быть рассчитан на стойкость к экстремально высоким показателям артериального давления. Мы надеемся, что, развивая нашу работу дальше, мы сможем создать хороший продукт, который позволит после клинических испытаний пересаживать его пациентам.
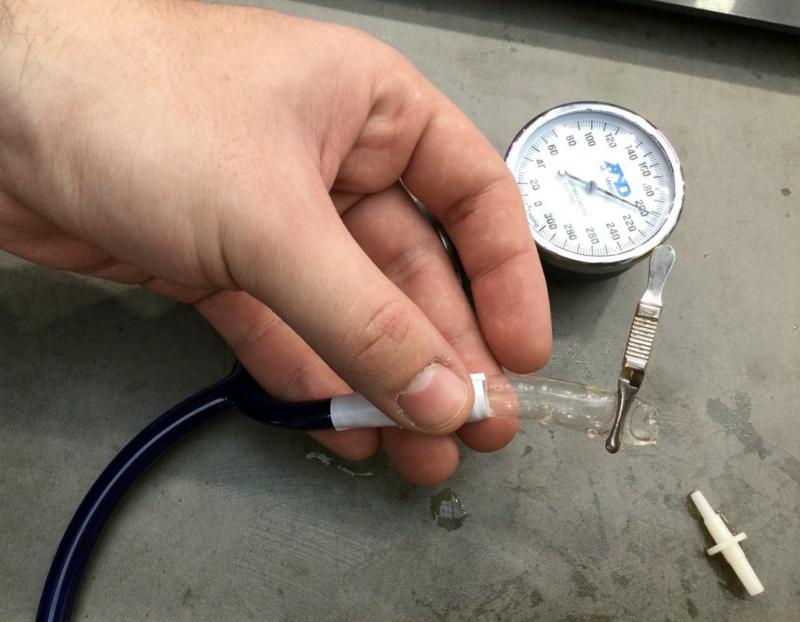
Тестирования гидрогелевой модели кровеносного сосуда высоким давлением на экспозиции проекта на Конгрессе молодых учёных 2023. Фото Н. Лесковой.
— Испытания на животных вы уже проводите?
— Сейчас мы находимся на стадии доработки нашей технологии, параллельно проводим испытания in vitro – то есть, проводим испытания наших гидрогелей с клетками на предмет цитосовместимости, испытания их физических свойств. Надеюсь, через год-полтора мы перейдём к испытаниям на животных. По сути, перед нами сейчас стоит задача протестировать физические свойства гидрогелей как материала для получения сосуда, протестировать его совместимость с клетками, затем перейти к исследованиям на животных и двигаться дальше, к конкретным пациентам.
— Каким образом вы планируете испытывать это на животных? Это будут лабораторные мыши?
— Мы надеемся, что это будут мини-пиги. Они крупнее и с ними проще работать, получать сосуды большего диаметра. Мы будем им пересаживать участки сосудистых протезов, которые мы получим в наших моделях кровеносных сосудов, проверять под УЗИ-контролем проходимость кровеносных сосудов, их инфильтрацию, будем брать анализ крови, чтобы понять, нет ли воспаления.
— Всё-таки почему вы думаете, что ваши протезы лучше, чем то, что уже есть?
— В первую очередь, потому что мы будем заселять их клетками организма пациентов. Пациентоспецифичные клетки имеют антигенный состав, идентичный организму, поэтому они не должны вызывать иммунологического отторжения.
— Где вы будете брать эти клетки?
— На данный момент это клетки из Банка клеток, заготовленные специально для нашей лаборатории. В будущем мы будем брать у пациента клетки сосудистой стенки, заручившись его добровольным информированным согласием. Затем мы поместим эти клетки в гидрогель, исследуем их метаболическую активность, их рост под микроскопом и проведём тестирование на выживаемость клеток в нашем материале.
— А когда наступает этап 3D-печати?
— В тот момент, когда нужно гидрогель, в который мы заселили клетки, преобразовать в трубчатую форму, соответствующую модели кровеносных сосудов. Мы заселяем клетками гидрогель, затем суспензию клеток помещаем в литейную форму, где буквально за полчаса можем получить трубчатую структуру, а затем культивируем в лаборатории эту трёхмерную структуру кровеносного сосуда.
— Означает ли это, что каждая такая структура будет индивидуально подобрана под конкретного пациента?
— В идеале – да. Это переход к персонифицированной медицине.
— Как думаете, когда начнутся клинические испытания?
— В течение ближайших трёх лет, если мы сможем доказать эффективность разработанной нами технологии в экспериментах на животных.
— Есть ли где-то подобные разработки?
— Подобных разработок с использованием именно литейных форм нет. Есть разработки, связанные с биопринтингом и с электроспиннингом. Недостатки первой технологии – очень высокая цена на биопринтеры, необходимость их импорта из-за границы и сложная эксплуатация. Однако это сейчас наиболее «модное» направление в биомедицине и создании искусственных органов, которое пытаются развивать очень крупные лаборатории, например, в Калифорнийском университете США и в Сеченовском университете в России.
Что касается электроспиннинга, это технология получения сосудистых протезов путём наслаивания нитей полимера в электромагнитном поле. Главные недостатки такой технологии – пористость получаемых моделей кровеносных сосудов, что увеличивает риски тромбообразования, и возможность получения лишь линейных моделей кровеносных сосудов без сложных ветвящихся конфигураций. Разработки в этом направлении ведутся, например, в Кемерово и Томске.
Наш же подход принципиально иной – мы используем простую и распространённую технологию 3D-печати, получаем литейные формы, которые можно применять неограниченное количество раз для формовки большого числа сосудистых моделей, тем самым более эффективно заменяя технологию биопринтинга.
— Расскажите о ваших впечатлениях о Конгрессе молодых учёных. Вызвала ли интерес ваша разработка?
— Впечатления от Конгресса положительные. Мы получили возможность показать наш проект широкой аудитории, получили хорошие отзывы от специалистов, ведущих научные разработки в сфере биомедицины, нашли заинтересованных в сотрудничестве коллег, продемонстрировали в ходе Конгресса разработку зампреду правительства РФ Дмитрию Чернышенко и министру науки и высшего образования Валерию Фалькову, дали несколько интервью и, я надеюсь, достойно представили нашу alma mater – Рязанский государственный медицинский университет и Платформу университетского технологического предпринимательства, благодаря которой и состоялась эта поездка.



