
Некоторые проблемы современной электрохимии
«Наука и жизнь» №6, 1941.
 Сто пятьдесят лет назад, в 1791 г., болонский врач Луиджи Гальвани опубликовал сделанные им замечательные наблюдения над возникновением электрического тока в мышцах препарированной лягушки при соприкосновении с металлами. Хотя Гальвани не сумел распознать истинную природу поразившего его явления и полагал, что имеет дело с особой силой, которую он называл «животным электричеством», значение его открытия для развития химии было чрезвычайно ценно. Имя Гальвани навсегда связано с возникновением электрохимии.
Сто пятьдесят лет назад, в 1791 г., болонский врач Луиджи Гальвани опубликовал сделанные им замечательные наблюдения над возникновением электрического тока в мышцах препарированной лягушки при соприкосновении с металлами. Хотя Гальвани не сумел распознать истинную природу поразившего его явления и полагал, что имеет дело с особой силой, которую он называл «животным электричеством», значение его открытия для развития химии было чрезвычайно ценно. Имя Гальвани навсегда связано с возникновением электрохимии.
Опыты Гальвани вызвали большой интерес среди его современников, и многие ученые повторяли их. Особенно известны работы его соотечественника Вольта, который показал, что электрический ток возникает, если соединить концы двух соприкасающихся металлов любым влажным проводником. Вольта показал, что при соприкосновении двух металлов возникает скачок потенциала, и считал, что этот «контактный» потенциал и является источником тока, не придавая никакого значения химическим реакциям, протекающим на тех частях металлов, которые погружены в проводящий раствор. Теперь нам хорошо известно, что теория Вольта неправильна, так как электрическая энергия в работающем элементе может получаться только за счет превращения химической энергии, но вопрос о распределении всех скачков потенциала в цепи гальванического элемента является актуальным и в настоящее время.
В начале прошлого века электрохимия стала быстро развиваться по двум основным направлениям: 1) использование химических реакций для получения электрического тока и 2) использование электрического тока для осуществления химических процессов.
Создание гальванических элементов позволило систематически применять электролиз для разложения химических соединений и исследовать законы, которым он подчиняется. Однако электрическая энергия, получающаяся таким путем, была слишком дорога для широкого применения. Пришедшие на смену электростатической машине гальванические элементы были в семидесятых годах прошлого века вытеснены динамомашиной. Новые мощные источники постоянного тока позволили осуществить в промышленности давно известные в лаборатории методы электролиза. В течение двух десятков лет возникли крупнейшие производства — электролитическая рафинировка меди и цинка, электролитическое получение алюминия и щелочей. Были заложены основы современной электрохимической промышленности. Главные интересы электрохимиков сосредоточились на проблемах электролиза; несмотря на создание аккумуляторов, химические источники тока отошли на второй план.
Век автомобиля и подводной лодки, самолета и радио — двадцатый век — предъявил совершенно новые требования к масштабам производства и к качеству элементов и аккумуляторов. Мощность и экономичность, прочность, большой срок службы, малый вес и малые размеры — вот основные требования, которым существующие тины далеко еще не удовлетворяют. В лучших из этих типов дефицитные материалы используются не более чем наполовину. Так спустя сто лет проблема химических источников тока вновь привлекает к себе широкое внимание.
Непрерывно растет потребность промышленности в цветных и легких металлах, и растет удельный вес электрохимических методов их производства. Металл сегодняшнего дня — алюминий стал массовым материалом только после введения электролитического процесса. Достаточно сказать, что за шесть лет после пуска первых промышленных электролитических установок стоимость алюминия упала в 27 раз.
Такое же крупное развитие получит в близком будущем электролитическое производство магния, который придает ценнейшие свойства различным сплавам и начинает уже применяться в (виде чистого металла с тех пор, как удалось в значительной степени предохранить его от быстрого разрушения на воздухе. Классические методы электролитического получения водорода и щелочей и связанное с этим получение хлора все более вытесняют химические методы.
На возрастающие требования практики можно ответить только, поднимая теорию электрохимии на более высокий уровень.
* * *
Сто лет назад Фарадей заложил основы теоретической электрохимии. Установленные им законы, связывающие количество реагирующего вещества с количеством затраченного электричества, принадлежат к числу наиболее общих и точных законов природы.
Только к концу XIX и в начале XX вв., благодаря развитию термодинамики, электрохимия сделала новый существенный шаг вперед. Химическая термодинамика — учение о равновесии в химических системах — была применена Гельмгольцем, Гиббсом, Нернстом и Люисом к электрохимическим процессам, т. е. к таким реакциям, при которых возникает или расходуется электрическая энергия. Это дало возможность рассчитать разность потенциалов между электродами в условиях равновесия, например, в гальваническом элементе. Когда система находится в равновесии, ток не идет ни в ту, ни в другую сторону, так как электрохимическая реакция происходит с одинаковой скоростью в обоих направлениях. Для возможности практического использования электрохимической реакции необходимо заставить процесс протекать в определенном направлении. При этом электродный потенциал оказывается уже неравновесным, и поэтому те теоретические представления в электрохимии, которые опираются только на законы Фарадея и на термодинамику, недостаточны для понимания механизма этих процессов и управления ими. Развитие направлений, ставящих себе целью выяснение кинетики процессов, характерно для исследований XX в. В этом же направлении развивалась и молодая советская электрохимия.
Механизм электрохимических процессов оказался много сложнее, чем можно было предполагать. Для того, чтобы уяснить себе, какие теоретические задачи стоят перед современной электрохимией, рассмотрим, например, такой давно известный и, казалось бы, простой процесс, как электролиз воды. При громадных потребностях в водороде для синтеза аммиака этот процесс имеет очень широкое практическое применение везде, где электроэнергия достаточно дешева.
Образование газообразного водорода в результате электролиза слагается из следующих стадий: движение ионов в растворе, разряд в результате перехода электронов с электрода в раствор, соединение образовавшихся атомов водорода в молекулы и, наконец, выделение молекул водорода из раствора в виде пузырьков.
Чтобы процесс протекал с определенной скоростью, т. е. чтобы через ванну шел ток определенной силы, надо падение потенциала между металлом и раствором сделать больше того падения потенциала, при котором ионы одинаково быстро заряжаются и разряжаются (т. е. при котором ток не идет ни в ту, ни в другую сторону). Этот избыток электродного напряжения, называемый «перенапряжением», соответствует непроизводительному расходу энергии, который желательно свести к минимуму. Величина перенапряжения определяется затрудненностью той или иной стадии образования газообразного водорода. Как и во всех случаях, когда процесс протекает в последовательных стадиях, скорость самой медленной из них определяет скорость всего процесса. Вопрос о том, какая именно стадия является в каждом случае решающей, чрезвычайно важен для возможности влиять на процесс в желательную сторону.
Исследование кинетики указанных процессов сдвинулось с мертвой точки только после того, как стало ясно, что эта кинетика тесно связана с распределением зарядов в растворе вблизи электрода. Давно уже установлено, что на поверхности металлического электрода, погруженного в раствор соли, в результате перехода ионов металла в раствор возникает двойной электрический слой из свободных зарядов на поверхности металла и ионов противоположного знака в растворе. Стремление металла посылать свои ионы в раствор аналогично стремлению куска сахара, погруженного в воду, посылать в раствор молекулы сахара. И в том и в другом случае наступает момент, когда дальнейшее изменение состава раствора прекращается. Это равновесное состояние вовсе не означает, однако, что на поверхности раздела прекращается переход из твердого тела в раствор. Это значит лишь, что в единицу времени из раствора на твердое тело переходит столько же элементарных частиц, сколько их переходит с твердого тела в раствор.

Существенное различие между металлом и сахаром заключается в том, что в первом случае мы имеем дело с переходом заряженных частиц, и что, как оказывается, равновесному состоянию должно соответствовать определенное падение потенциала между металлом и раствором, так называемый равновесный электродный потенциал.
Двойной слой подобен конденсатору очень большой емкости (1 Емкость — отношение заряда, находящегося в каждой из обкладок конденсатора, к напряжению между ними (или разности потенциалов). *. Его обкладки сближены на расстояние молекулярных размеров, и на этом расстоянии, порядка нескольких стомиллионных долей сантиметра, возникают чрезвычайно мощные электрические поля, с падением потенциала в десятки миллионов вольт на сантиметр. Вполне понятно, что такие поля создают на поверхности раздела исключительные и своеобразные условия для протекания электрохимических реакций, деформируя ионы раствора, ускоряя или замедляя разряд ионов и их образование, разрушая решетку металла, способствуя образованию атомных и мономолекулярных слоев, и т. д.
В течение долгого времени двойной слой поддавался исследованию только косвенными методами. Например, поверхностное натяжение ртути на границе с раствором чрезвычайно зависит от наличия и строения двойного слоя на этой границе. Поверхностное натяжение тем меньше, чем больше зарядка поверхности. Так как измерение поверхностного натяжения может быть легко выполнено с большой точностью, оно было широко использовано для выяснения влияния различных факторов на строение двойного слоя. Этот метод, разработанный в свое время французским ученым Гуи, был широко использован в нашей лаборатории в Институте им. Карпова. В результате этих работ было показано, каким образом электрическое поле влияет на сгущение органических молекул на поверхности ртути. Последнее тесно связано со способностью ртути в большей или меньшей мере смачиваться водой. Если нанести каплю масла на поверхность ртути и менять заряд на последней, капля эта то становится совсем плоской (когда заряд поверхности уменьшается), то собирается и частично отрывается (когда заряд увеличивается и сильнее притягивает воду). На рисунках приведены фотографии капель масла, снятые при разных зарядах поверхности.
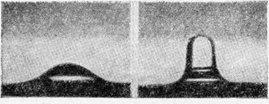
Слева — капля вазелинового масла на ртути при малом заряде поверхности; справа — та же капля при большом заряде поверхности в момент отрыва.
Из зависимости поверхностного натяжения от заряда поверхности, т. е. из так называемой электрокапиллярной кривой, можно вычислить емкость двойного слоя. Теория этих явлений разработана очень хорошо, и были все основания считать, что она дает вполне надежные значения для емкости. Однако в течение многих лет все попытки прямого экспериментального определения емкости таким же методом, как определяется емкость обычного конденсатора, всегда приводили к значениям, которые были в 2 — 5 раз меньше теоретических. Только в 1935 г. в нашей лаборатории М. А. Проскурнину, благодаря применению очень усовершенствованной экспериментальной техники, удалось показать, что слишком низкие значения всегда получались в результате загрязнения поверхности органическими соединениями, сгущающимися на поверхности. Органические молекулы раздвигают заряды двойного слоя и тем самым снижают его емкость. После устранения этого существенного противоречия между теоретическими и экспериментальными данными, методы прямого определения емкости были широко применены для исследования строения двойного слоя в разных условиях.
Из прямых методов измерения емкости очень существенные результаты дал метод, заключающийся в сообщении металлу определенного заряда и наблюдения за устанавливающимся потенциалом. Эти исследования позволили выяснить характер строения двойного слоя на поверхности платины и других металлов в зависимости от состава и концентрации раствора и от потенциала поверхности металла. Они показали также, что в случае платины и других благородных металлов образование двойного слоя определяется не только зарядами ионов, но и адсорбированными слоями газов в атомарном состоянии (Т.е. где атомы ещё не соединились в молекулы.)*. Удалось показать еще, что поведение активного угля, высокие адсорбционные свойства которого давно известны и широко используются, подчиняется тем же закономерностям, как и поведение металлических электродов, и что адсорбция электролитов на угле представляет не что иное, как использование находящихся в растворе ионов для образования двойного электрического слоя.
Наряду с исследованием емкости в концентрированных растворах, в которых двойной слой имеет молекулярные размеры, представляет большой интерес исследование двойного слоя в разбавленных растворах, где он становится менее плотным, или, как говорят, более диффузным.

Цех электролитической рафинировки меди.
Строение диффузного двойного слоя имеет очень большое значение, так как им определяются такие основные вопросы, как устойчивость коллоидных систем. Поэтому особый интерес представляют полученные в нашей лаборатории результаты по непосредственному измерению емкости двойного слоя в очень разбавленных растворах на поверхности ртути, при различных значениях ее заряда. Оказалось, в полном соответствии с теорией, что при очень низком заряде поверхности емкость двойного слоя резко падает и имеет наименьшее значение, когда заряд поверхности равен нулю.
Совокупность всех этих данных дает полную картину двойного слоя в разнообразных условиях. Это углубленное понимание строения двойного слоя было необходимо для исследования механизма процессов, протекающих на поверхности металлического электрода.
* * *
Возвращаясь к затронутому выше вопросу о перенапряжении, мы теперь можем сказать, что скорость разряда и образования ионов должна зависеть в первую очередь от строения двойного слоя, поскольку этим строением определяется электрическое поле в двойном слое.
Разработанная нами теория действительно позволила связать перенапряжение на поверхности металла е распределением зарядов в двойном слое, которое до сих пор всегда изучалось только в коллоидной химии, а не в связи с электродными процессами.
Исследование емкости двойного слоя при помощи переменного тока разной частоты оказалось мощным орудием для изучения кинетики электродных процессов, так как при высоких частотах наиболее медленные электрохимические реакции не успевают следовать за быстрыми переменами направления электрического поля. Сложные и очень тонкие экспериментальные методы, в разработку которых было вложено очень много сил, умения и терпения большим коллективом нашей лаборатории, позволили выяснить в ряде случаев, какая стадия всего электродного процесса в целом представляет основные препятствия.
Оказалось, что в различных растворах и на электродах из разных металлов механизм перенапряжения различен. Например, в щелочных растворах, в которых практически проводится на никелевых электродах электролиз воды для получения водорода, самым медленным процессом является переход ионов водорода из молекулы воды на электрод. В свете этих новых теоретических представлений становятся понятными причины повышения перенапряжения в присутствии органических веществ.
Высокое перенапряжение не во всех случаях вредно. Так, например, при заряде аккумуляторов целесообразно расходовать электроэнергию на возрождение активной массы, а не на выделение газов. Можно сказать, что свинцовые аккумуляторы не могли бы существовать, если бы перенапряжение водорода на свинце и кислорода на перекиси свинца не было бы высоким.
Для того чтобы повысить качества существующих элементов и аккумуляторов, необходимо разобраться в механизме тех процессов, которые определяют их работу. До последнего времени в этом направлении было сделано недостаточно; по ряду вопросов господствовали неточные и даже в корне неправильные взгляды. Например, во многих учебниках электрохимии до сих пор еще говорится, что работа гальванического элемента быстро прекращается вследствие накопления водорода на положительном полюсе, и что для окисления этого водорода в элемент вводится деполяризатор. В этом объяснении не считаются с тем, что при потенциале положительного электрода в работающем элементе газообразный водород совершенно не может образовываться. Поэтому не может быть и речи о том, что он играет какую-то роль в электродном процессе. В действительности работа элемента лимитируется скоростью, с которой кислород может вступать в электрохимическую реакцию, получая при этом заряд с электрода и создавая, благодаря одновременному растворению цинка на другом полюсе, электрический ток во внешней цепи.
Уголь обладает способностью облегчать переход газообразного кислорода в ионизованное состояние, но при больших плотностях тока, которые представляют интерес при практическом использовании элементов, кислород не успевает ионизоваться, и потенциал электрода быстро падает. Скорость ионизации кислорода повышается в присутствии различных катализаторов. Это используется на практике для элементов «воздушной деполяризации».
В гальваническом элементе источником электродвижущей силы может быть не только кислород, но и различные окислители.
В элементе Лекланше таким окислителем является двуокись марганца, но хорошо использовать имеющийся в ней запас кислорода можно только при слабой плотности тока на поверхности двуокиси марганца. Для улучшения работы элемента в него вводится графит, роль которого, как оказывается, сводится к снижению плотности тока на каждом зерне двуокиси марганца благодаря обволакиванию зерна проводящим слоем графита.
Аналогична роли двуокиси марганца в элементе Лекланше роль окиси никеля в щелочном аккумуляторе, однако аккумуляторы отличаются от элементов тем, что они после разряда вновь могут быть приведены в прежнее состояние, если пропускать через них электрический ток. Электрохимические процессы, протекающие в щелочном аккумуляторе, были подробно исследованы в нашей лаборатории Б. Б. Эршлером. Удалось очень полно выяснить, что происходит на положительном полюсе во время заряда и во время разряда, т. е. во время работы аккумулятора. Ряд вытекающих из этих исследований выводов уже нашел некоторое применение на практике.
Из всех видов химических источников тока наибольшее народнохозяйственное и оборонное значение имеют свинцовые аккумуляторы. Их работа основана на превращении перекиси свинца и металлического свинца в сернокислый свинец. Несмотря на то, что основы этого процесса известны уже давно, в его механизме оставалось еще много неясных мест. Использование нового теоретического подхода и новых экспериментальных методов Б. Н. Кабановым и другими существенно сдвинуло разрешение очень важных практических вопросов.
Еще увлекательнее представляется изыскание новых химических источников тока. Чрезвычайно заманчивая проблема — использовать для получения электрической энергии непосредственно химическую энергию угля, вместо того чтобы сжигать уголь в топках и превращать тепловую энергию в электрическую,— еще не разрешена.
Значительно ближе техническое разрешение вопроса о получении электрической энергии из химической энергии кислорода и водорода (последний может быть получен из угля и воды). Основные трудности заключаются в конструкции электродов и в выборе подходящих катализаторов. В этом направлении П. М. Спиридоновым достигнуты уже обнадеживающие результаты.
Будущее химических источников тока заключается в применении только самых дешевых и не дефицитных материалов: углерод, водород и кислород, а не свинец, никель и цинк должны лежать в основе используемых электрохимических процессов.
Наряду с такими электрохимическими процессами, которые сознательно применяются на пользу человечеству, существует, к сожалению, огромная область самопроизвольно протекающих, чрезвычайно вредных электрохимических процессов: 40% мировой продукции ценных металлических изделий гибнет ежегодно в результате коррозии, т. е. саморастворения металлов и их окисления кислородом воздуха.

Промышленный электролизер для получения водорода.
В исследованиях по коррозии в течение долгого времени недостаточно использовались результаты, получавшиеся в других областях электрохимии, в частности, результаты работ по теории электродных процессов. Целью работ, которые проводятся в Институте им. Карпова и в Коллоидно-электрохимическом институте Академии Наук СССР является восполнение этого пробела. Здесь достигнуты уже некоторые первоначальные результаты. Так, в самое последнее время удалось показать на примере свинца и никеля, что количественная теория перенапряжения может быть с успехом применена к явлениям саморастворения металлов и на основании ее можно дать полную картину этого процесса. Это направление открывает интересные возможности для дальнейшего развития учения о коррозии.



